Włókniakomięsak guzowaty skóry - przyczyny, objawy i leczenie
Włókniakomięsak guzowaty skóry
Włókniakomięsak guzowaty skóry (ang. dermatofibrosarcoma protuberans, DFSP) – mięsak skóry zaliczany do grupy nowotworów tkanki włóknistej z fibroblastów i miofibroblastów o granicznej złośliwości rzadko przerzutujących [1] . Choroba cechuje się powolnym, wieloletnim wzrostem. Początkowo nowotwór przyjmuje formę twardej blaszki koloru czerwonego do niebieskiego, która w miarę postępu choroby ulega uniesieniu z wytworzeniem kilku guzków [2] [3] . Kliniczne podejrzenie choroby jest stawiane na podstawie obrazu klinicznego, jednak niezbędne jest potwierdzenie rozpoznania na podstawie badania histopatologicznego materiału uzyskanego podczas biopsji [4] . Podstawową metodą leczenia jest chirurgiczne wycięcie guza w marginesie zdrowych tkanek. W przypadku nawrotu konieczna jest ponowna operacja. Chorobę nieoperacyjną i chorobę z przerzutami leczy się za pomocą imatynibu [5] .
Czym jest włókniakomięsak?
Włókniakomięsak (fibrosarcoma) jest nowotworem tkanki łącznej zbudowanym z fibroblastów i miofibroblastów, należących do grupy mięsaków tkanek miękkich (MTM). Stanowi zaledwie 1-2 proc. wszystkich mięsaków wykrywanych u dorosłych, zaś cała grupa MTM należy do 1 proc. wszystkich nowotworów złośliwych.
Włókniakomięsak manifestuje się w każdym wieku, ale zazwyczaj jest diagnozowany u osób w średnim wieku (mediana wieku chorych wynosi 45 lat). Warto jednak podkreślić, że występuje także u dzieci, głównie u noworodków. W grupie zwiększonego ryzyka zachorowania są osoby cierpiące na nerwiakowłókniakowatość typu NF1 i NF2, zespół Li-Fraumeni, zespół Gardnera, zespół Wernera.
Fibrosarcoma może występować w każdej części ciała. Najczęściej jednak atakuje głębokie tkanki miękkie kończyn, jamę otrzewnową lub okolice głowy i szyi.

Etiologia [ edytuj | edytuj kod ]
Kliniczne podejrzenie mięsaka może być postawione na podstawie wywiadu i badania fizykalnego [13] . Do potwierdzenia rozpoznania konieczne jest wykonanie biopsji i ocena pobranego materiału tkankowego w badaniu histopatologicznym [4] .
Badania obrazowe [ edytuj | edytuj kod ]
Rezonans magnetyczny (MRI) może być przydatny w ocenie głębokości zmiany przed wykonaniem zabiegu chirurgicznego [7] . Jest to metoda dokładniejsza niż ultrasonografia, którą także można wykorzystać w ocenie głębokości naciekania sąsiadujących tkanek [8] .
Ze względu na stosunkowo rzadką obecność przerzutów nie wymaga się rutynowego wykonywania szerokiej diagnostyki obrazowej w celu oceny zaawansowania choroby, chyba że wywiad, badanie fizykalne lub stwierdzone niekorzystne czynniki ryzyka przemawiają za koniecznością poszerzenia diagnostyki [4] [25] [8] . Niektórzy autorzy w przypadku bardzo rozległej i zaawansowanej miejscowo choroby zalecają wykonanie tomografii komputerowej klatki piersiowej w celu wykluczenia rozsiewu do płuc, choć zwykle wystarczające jest wykonanie zdjęcia rentgenowskiego klatki piersiowej [8] [13] .
Biopsja [ edytuj | edytuj kod ]
W celu uzyskania materiału tkankowego do przeprowadzenia badania histopatologicznego konieczne jest wykonanie biopsji [8] . Zaleca się wykonanie głębokiej biopsji gruboigłowej lub biopsji nacinającej, które pozwalają na uzyskanie reprezentatywnego materiału do badania [4] . Unika się wykonywania biopsji cienkoigłowych, ponieważ mogą nie dostarczyć odpowiedniej ilości odpowiedniego materiału biologicznego do ostatecznego rozpoznania mięsaka [8] [13] .
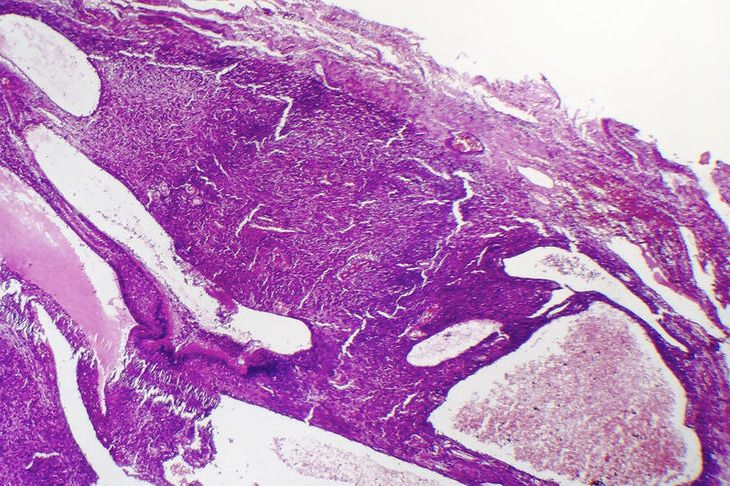
Badanie histopatologiczne [ edytuj | edytuj kod ]
Ostateczne rozpoznanie włókniakomięsaka guzowatego skóry może być postawione na podstawie badania histopatologicznego materiału uzyskanego podczas biopsji nacinającej, wycinającej lub gruboigłowej [25] [31] . W większości przypadków badanie mikroskopowe jest wystarczające do postawienia rozpoznania [4] . Materiał po odpowiednim wybarwieniu ocenia się pod mikroskopem, w którym wykazuje się obecność rozlanego nacieku skóry i tkanki podskórnej złożonego z komórek wrzecionowatych ułożonych wirowato [25] . Jednak w celu potwierdzenia rozpoznania wykonuje się badanie immunohistochemiczne [4] [25] . Rutynowo nie ma konieczności wykonywania badań genetycznych [31] . W diagnostyce różnicowej uwzględnia się guz histiocytarny włóknisty, niezróżnicowany mięsak pleomorficzny, mięśniakomięsak gładkokomórkowy, złośliwy nowotwór osłonek nerwów obwodowych i czerniaka [25] .
Leczenie [ edytuj | edytuj kod ]
Podstawową metodą leczenia włókniakomięsaka guzowatego skóry jest chirurgiczne wycięcie zmiany z szerokim marginesem zdrowych tkanek lub metodami chirurgii mikrograficznej. Nawroty również leczy się operacyjnie. Choroba nieoperacyjna, nieoperacyjne nawroty i choroba z przerzutami wymagają leczenia ogólnoustrojowego opartego na imatynibie [5] .
Leczenie chirurgiczne [ edytuj | edytuj kod ]
Resekcja zmiany w zakresie marginesu zdrowych tkanek bez nacieku nowotworowego jest podstawową metodą leczenia włókniakomięsaka guzowatego skóry [37] . Ze względu na asymetrię guza, częste rozległe poziome (horyzontalne) i pionowe naciekanie, które nie jest widoczne makroskopowo, osiągnięcie ujemnych marginesów może być trudne [8] . Przed operacją istotne jest dokładne zaplanowanie zakresu zabiegu, tak by uzyskać pożądaną radykalność przy uwzględnieniu akceptowalnego efektu kosmetycznego. Zabiegi rekonstrukcyjne są wykonywane po pełnej ocenie histopatologicznej i potwierdzeniu resekcji guza w zakresie zdrowych tkanek [25] . Operacja może być wykonana metodą szerokiego miejscowego wycięcia lub chirurgii mikrograficznej Mohsa [37] , choć niektórzy autorzy wskazują na metodę mikrograficzną Mohsa jako technikę z wyboru [7] .
Technika szerokiego miejscowego wycięcia polega na resekcji zmiany z zachowaniem marginesu szerokości 2–4 cm [37] [8] . Nie osiągnięcie wolnych marginesów chirurgicznych od nacieku nowotworowego wymaga wykonania ponownej operacji w celu poszerzenia marginesów resekcji i uzyskania ujemnych marginesów [37] [25] [31] . Część ośrodków wykonuje szersze marginesy resekcji w celu mniejszego prawdopodobieństwa konieczności wykonania ponownej operacji lub nawrotu, a część wykonuje węższe marginesy 1–2 cm, co jednak często wymaga ponownych operacji i znacznie upodabnia metodę do techniki Mohsa [8] . Obecnie przy stosowaniu techniki szerokiego wycięcia ryzyko nawrotu jest stosunkowo niskie, w różnych pracach waha się ono od 1% do około 10% [38] [39] [40] [41] [42] [43] . W dużym retrospektywnym badaniu przy zastosowaniu szerokiego wycięcia ryzyko nawrotu wynosiło 1% [38] .
Epidemiologia [ edytuj | edytuj kod ]
Włókniakomięsak guzowaty skóry jest najczęstszym mięsakiem skóry [6] , stanowi poniżej 1% wszystkich mięsaków tkanek miękkich u ludzi [7] . Mięsak może pojawiać się w dowolnej grupie wiekowej, ale najczęściej rozpoznaje się go u osób młodych i w średnim wieku pomiędzy 20. a 50. rokiem życia [7] [6] . Szacuje się, że 5–20% przypadków włókniakomięsaka guzowatego skóry dotyczy dzieci [7] . Ze względu na powolny rozwój choroby uważa się, że znaczna część przypadków rozpoznawanych w wieku dorosłym faktycznie ma początek w wieku dziecięcym [7] [2] .
Roczna zapadalność na włókniakomięsaka guzowatego skóry jest szacowana na 0,8–4,5 przypadków na milion [7] [8] [9] [10] . Zapadalność jest podobna u obu płci, choć niektóre badania wskazują na częstsze występowanie u mężczyzn [8] [7] . Niektóre badania sugerują częstsze występowanie choroby u osób rasy czarnej w porównaniu do rasy kaukaskiej [7] [9] .
 U nas zapłacisz kartą
U nas zapłacisz kartą
